| |
| Med Sci (Paris). 2009 February; 25(2): 197–200. Published online 2009 February 15. doi: 10.1051/medsci/2009252197.Incidence mondiale et prise en charge des envenimations ophidiennes et scorpioniques Jean-Philippe Chippaux* Unité de recherché « Santé de la mère et de l’enfant en milieu tropical », IRD UR010, Université Paris Descartes, 4, avenue de l’Observatoire, 75270 Paris Cedex 06, France |
Dans les pays tropicaux, les morsures de serpent et les piqûres de scorpion sont redoutées par les populations qui les considèrent au mieux comme une fatalité, au pire comme un maléfice. Elles sont également craintes par le personnel de santé qui hésite sur la conduite à tenir et reste désemparé devant l’évolution imprévisible d’une symptomatologie spectaculaire. Plusieurs études récentes soulignent le paradoxe de cette urgence médicale fréquente et néanmoins négligée malgré une mortalité élevée. Il est lié à la méconnaissance de l’épidémiologie des envenimations et à l’inaccessibilité des moyens thérapeutiques. Le sérum antivenimeux reste controversé, bien qu’efficace, en raison du risque supposé de réactions indésirables graves. La rencontre entre un animal venimeux et l’homme n’est pas fortuite. Elle est la conséquence de comportements et d’activités explicables, voire prévisibles. L’évaluation de l’incidence et de la gravité des envenimations est rendue difficile par la rareté et le manque de fiabilité des sources d’information. En revanche, la technologie des antivenins est désormais maîtrisée et l’on dispose de produits efficaces et bien tolérés [
1]. Cependant, leur coût et les difficultés de leur distribution en limitent considérablement l’utilisation [
2]. Une meilleure connaissance de la morbidité et de la mortalité par morsures de serpent permettrait sans aucun doute d’améliorer leur prise en charge et l’accessibilité des antivenins afin de réduire sinon l’incidence, du moins la létalité et les séquelles [
3]. |
L’incidence et la mortalité par envenimation sont sous-estimées Une première estimation de l’incidence et de la mortalité par morsures de serpent dans le monde avait été faite en 1954 [
4]. Elle concluait à 500 000 envenimations et 40 000 morts annuels dans le monde (bloc soviétique et Chine exclus). En 1998, une seconde évaluation estimait que 5 millions de morsures de serpent, dont la moitié d’envenimations, occasionnant 125 000 décès, survenaient chaque année [
5]. Selon Kasturiratne et al. [
6], le nombre de morsures de serpent atteindrait annuellement 5,5 millions et celles-ci provoqueraient 20 000 à 94 000 décès (Tableau I ; Figure 1). Par ailleurs, l’on dénombrerait 1,2 million de piqûres de scorpion par an, occasionnant 3 000 morts, de jeunes enfants pour la plupart [
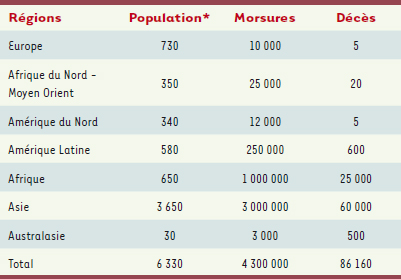
7], avec une distribution géographique plus limitée (Tableau II ; Figure 2).  | Tableau I.
Incidence et mortalité géographiques des envenimations ophidiennes. Les envenimations nécessitant une intervention thérapeutique représentent en moyenne deux tiers de l’incidence. * Millions d’habitants (d’après [ 5, 6]). |
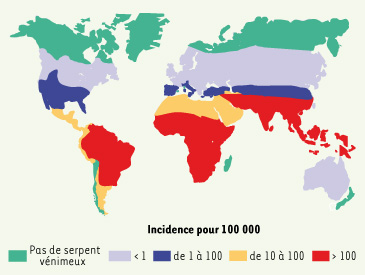
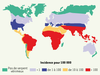 | Figure 1.
Incidence mondiale des morsures de serpent. L’incidence prédomine en zones rurales où elle affecte en majorité les actifs agricoles de sexe masculin. La létalité est comprise entre 1 et 10 % en fonction des régions et de l’accessibilité aux soins ; les séquelles sont évaluées à 10 ou 15 % des envenimations (d’après [ 5]). |
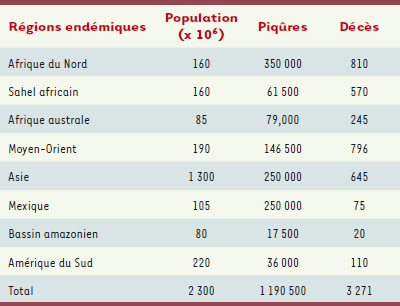
 | Tableau II.
Incidence et mortalité géographiques des piqûres de scorpion. Seules les régions d’endémie scorpionique sont prises en considération. L’incidence est plus élevée en zone rurale mais reste significative en ville. Les envenimations représentent moins de la moitié de l’incidence. La mortalité concerne essentiellement les enfants de moins de 10 ans (d’après [ 7]). |
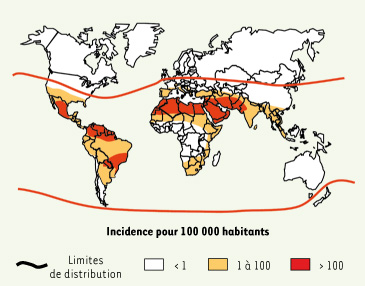
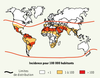 | Figure 2.
Incidence mondiale des piqures de scorpion. L’incidence est essentiellement limitée à quatre régions fortement endémiques : Mexique, Amérique du Sud à l’Est des Andes, Afrique du Nord, Proche et Moyen-Orient. Les piqûres ont surtout lieu à domicile pendant la nuit et concernent l’ensemble de la population (d’après [ 7]). |
Le décompte et la publication des cas d’envenimation par les autorités sanitaires sont inexistants dans la plupart des pays en développement. Il faut donc avoir recours à d’autres techniques de recueil de données. Le recensement rétrospectif des sujets envenimés à partir des registres des centres de santé et des statistiques sanitaires reste le moyen le plus courant et le plus accessible. Les enquêtes prospectives sur les cas traités dans les centres de santé permettent de mieux documenter certains aspects comme la symptomatologie, les complications ou l’efficacité du traitement, mais elles sont plus longues et plus coûteuses. Cependant, ces techniques ne considèrent qu’une fraction des événements puisque, dans la majorité des pays en développement, l’on estime que 40 à 80 % des victimes se rendent chez les thérapeutes traditionnels [
8]. Cela a été documenté en Afrique [
9–
11], et dans une moindre mesure en Asie [
12] et en Amérique latine [
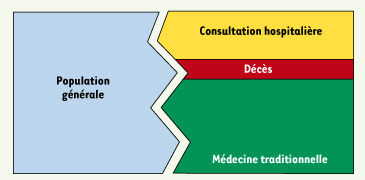
13]. Plus récemment, les enquêtes auprès des ménages ont permis de préciser l’incidence des morsures de serpent ou des piqûres de scorpion dans une communauté et d’évaluer les besoins immédiats en termes de traitements des morsures de serpent, notamment en antivenins. Cette technique consiste à interroger un échantillon représentatif de la population pour connaître l’incidence et la mortalité et identifier le parcours thérapeutique des victimes (Figure 3). Validée par des suivis prospectifs de populations qui ont confirmé sa fiabilité [
14], cette évaluation est complémentaire de celle faite par des enquêtes hospitalières.  | Figure 3.
Incidence et parcours thérapeutique des victimes dans les pays du Sud. Les enquêtes hospitalières ne concernent qu’une minorité des victimes (à droite). La majorité d’entre elles s’adresse à la médecine traditionnelle et ne se rend pas à l’hôpital. En conséquence, l’incidence est sous-évaluée alors que la mortalité est probablement mieux connue. |
Cependant, les données recueillies dans la littérature proviennent généralement d’études locales et dispersées. Le principal problème est donc leur représentativité et la possibilité de généraliser les résultats à d’autres régions géographiques. Schématiquement, les envenimations par Elapidae (cobra ou naja, mamba, bongare, serpent corail et marin) s’opposent aux envenimations par Viperidae (vipère et crotale). Les premières sont neurotoxiques entraînant la mort par paralysie respiratoire. Les secondes sont inflammatoires (œdème compressif), hémotoxiques (syndromes hémorragiques ou thrombotiques) et nécrosantes (amputation). En pratique, il est des exceptions : inflammation et hémorragie avec les Elapidae ou neurotoxicité chez les Viperidae. |
Les antivenins, outils thérapeutiques appropriés mais mal utilisés La découverte des sérums antivenimeux remonte à la fin du XIXe siècle. Henry Sewall en 1887 (université du Michigan) a montré que l’inoculation de venin à un animal le rendait résistant à toute inoculation ultérieure de ce même venin. Emile Roux et Alexandre Yersin (Institut Pasteur), quelques années plus tard, établissent que le sang d’un animal immunisé contre la toxine diphtérique protège un animal naïf. Se fondant sur ces découvertes, Phisalix et Bertrand (Muséum National d’Histoire Naturelle de Paris) et Calmette (Instituts Pasteur de Paris et de Saïgon), d’autre part, publient indépendamment mais le même jour (10 février 1894), les travaux qui fondent la découverte du sérum antivenimeux. Cependant, c’est à Calmette que l’on doit le développement médical de la sérothérapie antivenimeuse [
15]. Les chevaux sont immunisés à l’aide d’injections répétées de venin contre lequel ils développent des anticorps. Calmette utilisait le sérum complet des chevaux d’où le nom de « sérum antivenimeux ». Aujourd’hui, les immunoglobulines (IgG) sont séparées du plasma, puis fragmentées par digestion enzymatique avant que les fragments F(ab’)2 soient purifiés et traités contre les contaminations infectieuses, protéiques et chimiques [1]. On désigne ces préparations sous le terme d’« antivenin ». Elles sont à la fois efficaces et très bien tolérées, mais coûteuses. À cela s’ajoutent les difficultés du parcours thérapeutique, du financement et de la logistique commerciale [8]. La victime ou son entourage choisit le plus souvent de s’adresser à la médecine traditionnelle plutôt que de se rendre à l’hôpital, à la fois éloigné, débordé et sous-équipé. Depuis 20 ans, rien qu’en Afrique, la vente annuelle d’antivenins a diminué de façon considérable, de plus de 150 000 ampoules à moins de 20 000. Le prix d’une dose a été multiplié par 10, ce qui représente plusieurs mois du revenu moyen d’une famille de paysans. Les principales raisons avancées par les fabricants pour justifier une telle augmentation sont la complexité et le coût de production. Mais il en est d’autres. En premier, le marché instable de l’antivenin et les marges bénéficiaires faibles conduisent les pharmaciens et les centres de santé à ne plus s’approvisionner, ce qui compromet la rentabilité des antivenins. Ensuite, l’absence de données épidémiologiques, en ne permettant pas d’identifier les zones à risque, pénalise sa distribution. Enfin, la formation médicale des infirmiers et des médecins ne comporte plus, même dans les pays du sud, d’enseignement dédié aux envenimations ; il en résulte un déficit de prescription et une utilisation inappropriée. |
Répondre aux besoins réels Une meilleure connaissance de la morbidité et de la mortalité par envenimation permettrait d’en améliorer la prise en charge et de réduire la létalité de 90 % [2]. Les fabricants d’antivenins pourraient en ajuster la fabrication et les autorités sanitaires favoriser leur distribution. L’information épidémiologique nécessite une standardisation méthodologique, notamment sur les données pertinentes, et doit associer enquêtes hospitalières et enquêtes auprès des ménages. L’OMS vient d’annoncer la validation, par son comité d’experts pour la standardisation biologique, de recommandations pour l’amélioration de la production, du contrôle de qualité, de la validation clinique et de l’enregistrement des antivenins [
16]. L’espoir d’une évoluation favorable ? |
1. Chippaux JP, Goyffon M. Venoms, antivenoms and immunotherapy. Toxicon 1998; 36 : 823–46. 2. Chippaux JP. The development and use of immunotherapy in Africa. Toxicon 1998; 36 : 1503–6. 3. Stock RP, Massougbodji A, Alagón A, Chippaux JP. Bringing antivenom to Sub-Saharan Africa. Nat Biotech 2007; 25 : 173–7. 4. Swaroop S, Grab B. Snake bite mortality in the world. Bull WHO 1954; 10 : 35–76. 5. Chippaux, JP. Snake-bites: appraisal of the global situation. Bull WHO 1998; 76 : 515–24. 6. Kasturiratne A, Wickremasinghe AR, de Silva N, et al. The global burden of snakebite: a literature analysis and modelling based on regional estimates of envenoming and deaths. PLoS Med 2008; 5 : e218. 7. Chippaux JP, Goyffon M. Epidemiology of scorpionism: a global appraisal. Acta Tropica 2008; 107 : 71–9. 8. Chippaux JP. The treatment of snake bites: analysis of requirements and assessment of therapeutic efficacy in tropical Africa. In : Ménez A, ed. Perspectives in molecular toxinology. Chichester: John Wiley and Sons Ltd, 2002 : 457–72. 9. Baldé MC, Camara AMB, Bah H, et al. Incidence des morsures de serpent : enquête communautaire dans la collectivité rurale de développement (CRD) de Frilguiagbé (République de Guinée). Bull Soc Pathol Exot 2005; 98 : 283–4. 10. Coombs MD, Dunachie SJ, Brooker S, et al. Snake bites in Kenya: a preliminary survey of four areas. Trans R Soc Trop Med Hyg 1997; 91 : 319–21. 11. Newman WJ, Moran NF, Theakston RDG, et al. Traditional Treatments for snake bite in a rural African community. Ann Trop Med Parasitol 1997; 91 : 967–9. 12. Sharma SK, Chappuis F, Jha N, et al. Impact of snake bites and determinants of fatal outcomes in southeastern Nepal. Am J Trop Med Hyg 2004; 71 : 234–8. 13. Russell FE, Walter FG, Bey TA, Fernandez MC. Snakes and snakebite in Central America. Toxicon 1997; 35 : 1469–522. 14. Guyavarch E, Chippaux JP. Mesurer l’incidence des morsures de serpents : méthodologie d’enquête auprès des ménages (l’exemple de Bandafassi, Sénégal). Bull Soc Pathol Exot 2005; 98 : 269–72. 15. Goyffon M, Chippaux JP. La découverte du sérum antivenimeux (10 février 1894). Biofutur 2008; 292 : 32–5. 16. WHO. Guidelines on production, control and regulation of snake antivenom immunoglobulins. Genève : OMS, 2009 (sous presse). |